Índice
Enzimas
Definición
Función Principal
Estructura
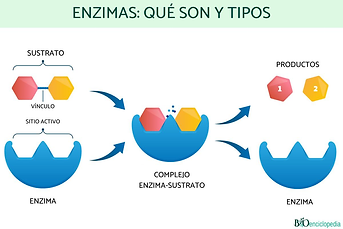
Las enzimas son proteínas que actúan como catalizadores biológicos, es decir, aceleran las reacciones químicas sin alterarlas ni cambiar su equilibrio.
Es disminuir la energía de activación necesaria para que ocurra una reacción, lo cual facilita que estas se lleven a cabo en condiciones compatibles con la vida celular.
Están formadas por cadenas polipeptídicas que adoptan una estructura tridimensional, en la que se encuentra el sitio activo, una zona específica donde se une el sustrato (reactivo).
Durante la reacción, el sustrato se transforma en productos.


Principales Tipos
• Oxidoreductasas: Cataliza reacciones de oxidación-reducción.
Liasas: Cataliza reacciones de rotura de enlaces sin incorporar agua.
• Transferasas: Cataliza reacciones de transferencia de grupos.
Isomerasas: Cataliza reacciones de transferencia de grupos para formar isómeros.
Hidrolasas: Cataliza reacciones de hidrólisis, es decir, rotura de enlaces por incorporación de una molécula de agua
Ligasas: Cataliza reacciones que provocan la unión de moléculas.
Mecanismo de acción
Cinética enzimática
Factores que afectan la velocidad
Efecto de la concentración de sustrato

Es el conjunto de procesos mediante los cuales las enzimas catalizan reacciones químicas.
Este mecanismo depende de la composición, la estructura de la enzima y su especificidad por el sustrato.

Para entender cómo actúan las enzimas, se estudia la velocidad de las reacciones que catalizan y los factores que la modifican. Este estudio se llama cinética enzimática.
Concentración de enzima
Concentración de sustrato (varía durante la reacción)
Temperatura y pH
Presencia de inhibidores
Fase inicial
La velocidad aumenta de forma lineal al aumentar la concentración de sustrato.
El enzima está mayormente libre.
Fase intermedia
El aumento de la concentración de sustrato provoca un menor aumento de la velocidad.
Se empieza a formar más complejo enzima-sustrato.
Fase de saturación
A concentraciones muy altas de sustrato, la velocidad se estabiliza y alcanza un valor máximo constante.
El enzima está saturado: casi todo está en forma de complejo enzima-sustrato.
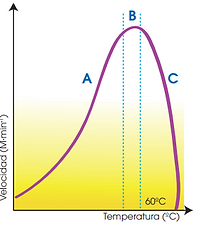
Temperatura
Aumento inicial: La velocidad de la reacción aumenta al subir la temperatura porque se incrementa
Temperatura óptima: La velocidad máxima se alcanza en una temperatura óptima (variable según el enzima)
Descenso por desnaturalización: A partir de aproximadamente 60 °C, la velocidad disminuye porque el enzima empieza a desnaturalizarse.




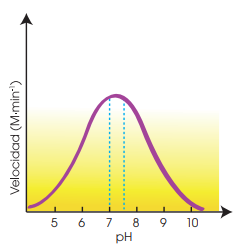
pH
Los cambios de pH alteran la actividad enzimática, ya que afectan el estado de ionización de los grupos funcionales del enzima.
La velocidad de reacción varía con el pH, describiendo una curva con un máximo.
El pH óptimo para la mayoría de los enzimas está entre 7 y 7,5.
En pH extremos (menor a 4 o mayor a 10), los enzimas pueden desnaturalizarse.
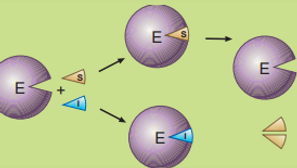
Inhibidores
Son sustancias que reducen la velocidad de la reacción al unirse al enzima.
Pueden hacerlo de forma reversible y muchas veces se parecen al sustrato.
Inhibidores competitivos: Compiten con el sustrato por el sitio activo del enzima
Inhibidores no competitivos: Se unen a otra parte del enzima y modifican su actividad, sin competir con el sustrato directamente.
En la inhibición competitiva, el inhibidor y el sustrato compiten por el sitio activo del enzima.
El inhibidor es similar al sustrato y se une cuando la concentración de sustrato es baja.
Si la concentración de sustrato aumenta, este desplaza al inhibidor, y el enzima recupera su actividad.
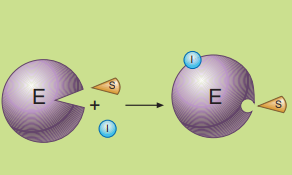
En la inhibición no competitiva, el inhibidor se une a una zona distinta del sitio activo, ya sea al enzima libre o al complejo enzima-sustrato.
Esta unión disminuye la actividad enzimática, sin importar si el sustrato está presente o no.
En algunos casos, el inhibidor es un metabolito de la propia célula, como ocurre con los enzimas reguladores.